Single-cell transcriptomics sequencing from 3’ cDNA prepared with 10X Genomics using SQK-LSK114 and EXP-PCA001 (SST_9198_v114_revP_06Oct2025)
PromethION: Protocol
V SST_9198_v114_revP_06Oct2025
FOR RESEARCH USE ONLY
Contents
Introduction to the protocol
Library preparation
- 3. Pre-pull-down PCR
- 4. Pull-down
- 5. Post-pull-down PCR
- 6. End-prep
- 7. Adapter ligation and clean-up
- 8. Priming and loading the PromethION Flow Cell
Sequencing and data analysis
Troubleshooting
1. Overview of the protocol
Introduction to the single-cell 3' transcriptomics protocol
This application allows the sequencing of full-length 3' cDNA transcripts, which provides a complete view of the expressed isoforms and allows detection of alternative splicing and fusion events in individual cells. Additionally, it enables the detection of SNPs anywhere in the transcript, as well as identification of cell sub-types in a population based on isoform expression levels.
This protocol describes how to carry out sequencing of cDNA from single cells using the Ligation Sequencing Kit V14 (SQK-LSK114) and the PCR Expansion (EXP-PCA001). You will need to have reverse-transcribed single-cell mRNA into cDNA using the 10x Genomics Chromium GEM-X Universal 3’ Gene Expression (V4) assay or the Chromium Next GEM Universal 3’ Gene Expression (V3.1) assay, to then biotin tag your cDNA before PCR amplification with custom-ordered oligos. Next, pull-down of the amplicons on streptavidin beads is performed before a second PCR using the PCR Primers (PRM). Finally, a standard Ligation Sequencing Kit V14 library preparation is completed to prepare the cDNA ends for sequencing on a PromethION device.
This is an optimised protocol adapted from Lebrigand, K., Magnone, V., Barbry, P. et al. High throughput error corrected Nanopore single cell transcriptome sequencing. Nat Commun 11, 4025 (2020) to sequence full-length transcripts, deplete cDNA synthesis artifacts and to correct for strand bias.
Note: This protocol is intended for use with the 10x Genomics Chromium GEM-X Universal 3’ Gene Expression (V4) assay or the Chromium Next GEM Universal 3’ Gene Expression (V3.1) assay.
For the 10x Genomics Chromium GEM-X Universal 5' Gene Expression (V3) assay or the Chromium Next GEM Universal 5' Gene Expression (V2) assay, please visit our Single-cell transcriptomics sequencing from 5’ cDNA prepared with 10x Genomics using SQK-LSK114 protocol.
For use with the 10x Genomics Visium Spatial Gene Expression (Visium V1 for Fresh Frozen) assay or the Visium HD 3' Spatial Gene Expression assay, please visit our Spatial transcriptomics sequencing from 3’ cDNA prepared with 10x Genomics using SQK-LSK114 and EXP-PCA001 protocol.
Steps in the sequencing workflow:
Prepare for your experiment
You will need to:
- Have previously prepared single-cell barcoded cDNA using the 10x Genomics Chromium GEM-X Universal 3’ Gene Expression (V4) assay or the Chromium Next GEM Universal 3’ Gene Expression (V3.1) assay. Please ensure you are using good quality sample input in this method. Additionally, the quality checks performed during the protocol are essential in ensuring experimental success.
- Ensure you have your sequencing kit, the correct equipment and third-party reagents.
- Download the MinKNOW software for acquiring and analysing your data.
- Perform a flow cell check to ensure it has enough pores for a good sequencing run.
Library preparation
| Protocol step | Process | Time | Stop option |
|---|---|---|---|
| Pre-pull down PCR | Biotin tag your cDNA and amplify by PCR. | 60 minutes | - |
| Pull-down | Pull-down the amplicons on streptavidin beads. | 40 minutes | - |
| Post-pull-down PCR | Amplify the amplicons by PCR with PCR Primers (PRM). | 50 minutes | - |
| End-prep | Prepare the cDNA ends for adapter attachment. | 30 minutes | 4°C overnight |
| Adapter ligation and clean-up | Attach sequencing adapters to the cDNA. | 20 minutes | 4°C for short-term storage or for repeated use, such as for reloading your flow cell. –80°C for long-term storage. |
| Priming and loading the flow cell | Prime the flow cell and load the prepared library for sequencing. | 10 minutes |
Sequencing and analysis
You will need to:
- Start a sequencing run using the MinKNOW software, which will collect raw data from the device and basecall the reads.
- Analyse the data using the EPI2ME wf-single-cell pipeline.
Compatibility of this protocol
This protocol should only be used in combination with:
- Ligation Sequencing Kit V14 (SQK-LSK114)
- PCR Expansion (EXP-PCA001)
- R10.4.1 flow cells (FLO-PRO114M)
- Flow Cell Wash Kit (EXP-WSH004)
- PromethION device - PromethION IT Requirements document
2. Equipment and consumables
材料
- 10 ng of cDNA amplicons prepared using the 10x Genomics Chromium GEM-X Universal 3’ Gene Expression (V4) assay or the Chromium Next GEM Universal 3’ Gene Expression (V3.1) assay
- Custom-ordered oligo at 10 μM: [Btn]Fwd_3580_partial_read1_defined_for_3'_cDNA (sequence provided below)
- Custom-ordered oligo at 10 μM: Rev_PR2_partial_TSO_defined_for_3'_cDNA (sequence provided below)
- Ligation Sequencing Kit V14 (SQK-LSK114)
- PCR Expansion (EXP-PCA001)
消耗品
- PromethION Flow Cell (FLO-PRO114M)
- LongAmp Hot Start Taq 2X Master Mix (NEB, M0533)
- NEBNext® Ultra™ II End Repair/dA-Tailing Module (NEB, E7546)
- Salt-T4® DNA Ligase (NEB, M0467)
- Qubit 1x dsDNA HS Assay Kit (ThermoFisher, Q33230)
- Agilent Technologies DNA 12000 Kit
- M280 streptavidin, 10 μg/μl (Invitrogen, 11205D)
- Agencourt AMPure XP beads (Beckman Coulter™, A63881)
- 1 M Tris-HCl, pH 7.5
- 5 M NaCl (Sigma, 71386)
- 0.5 M EDTA, pH 8 (Thermo Scientific, R1021)
- nuclease-free waterで調整した 80% エタノール溶液
- Nuclease-free water (e.g. ThermoFisher, AM9937)
- 15 ml Falcon tubes
- 1.5 ml Eppendorf DNA LoBind tubes
- 0.2 ml 薄壁のPCRチューブ
- Qubit™ Assay Tubes (Invitrogen, Q32856)
装置
- PromethION Flow Cell Light Shield
- PromethION device
- Agilent Bioanalyzer (or equivalent)
- Hula mixer(緩やかに回転するミキサー)
- Magnetic rack (e.g. Invitrogen DynaMag-2 Magnet, Cat # 12321D)
- 小型遠心機
- ボルテックスミキサー
- サーマルサイクラー
- P1000 ピペット及びチップ
- P200 ピペットとチップ
- P100 ピペットとチップ
- P20 ピペットとチップ
- P10 ピペットとチップ
- P2 ピペットとチップ
- アイスバケツ(氷入り)
- タイマー
- Qubit蛍光光度計(またはQCチェックのための同等品)
For this protocol, you will need 10 ng amplified cDNA amplicons prepared using the 10 ng of cDNA amplicons prepared using the 10x Genomics Chromium GEM-X Universal 3’ Gene Expression (V4) assay or the Chromium Next GEM Universal 3’ Gene Expression (V3.1) assay.
10x Genomics kits
Note: This protocol is intended for use with the 10 ng of cDNA amplicons prepared using the 10x Genomics Chromium GEM-X Universal 3’ Gene Expression (V4) assay or the Chromium Next GEM Universal 3’ Gene Expression (V3.1) assay.
The Single-cell transcriptomics sequencing from 5’ cDNA prepared with 10x Genomics using SQK-LSK114 protocol is intended for use with the 10x Genomics Chromium GEM-X Universal 5' Gene Expression (V3) assay or the Chromium Next GEM Universal 5' Gene Expression (V2) assay.
For use with the 10x Genomics Visium Spatial Gene Expression (Visium V1 for Fresh Frozen) assay or the Visium HD 3' Spatial Gene Expression assay, please visit our Spatial transcriptomics sequencing from 3’ cDNA prepared with 10x Genomics using SQK-LSK114 and EXP-PCA001 protocol.
Custom-ordered oligo sequences
Order the following HPLC-purified oligos at 100 μM, and dilute to 10 μM in TE buffer for use in the Pre-pull-down step of the library prep.
| Name | Sequence |
|---|---|
| [Btn]Fwd_3580_partial_read1_defined_for_3'_cDNA | 5'-/5Biosg/CAGCACTTGCCTGT CGCTCTATCTTCCTACA CGACGCTCTTCCGATCT-3' |
| Rev_PR2_partial_TSO_defined_for_3'_cDNA | 5'-CAGCTTTCTGTTGGTGCTGA TATTGCAAGCAGTGGTA TCAACGCAGAG-3' |
AMPure XP beads
Extra AMPure XP Beads will be required for the first steps when preparing the cDNA amplicons. From the end-prep step, the AMPure XP Beads (AXP) from the Ligation Sequencing Kit V14 (SQK-LSK114) can be used.
Input DNA
How to QC your input DNA
It is important that the input DNA meets the quantity and quality requirements. Using too little or too much DNA, or DNA of poor quality (e.g. highly fragmented or containing RNA or chemical contaminants) can affect your library preparation.
For instructions on how to perform quality control of your DNA sample, please read the Input DNA/RNA QC protocol.
Chemical contaminants
Depending on how the DNA is extracted from the raw sample, certain chemical contaminants may remain in the purified DNA, which can affect library preparation efficiency and sequencing quality. Read more about contaminants on the Contaminants page of the Community.
Third-party reagents
We have validated and recommend the use of all the third-party reagents used in this protocol. Alternatives have not been tested by Oxford Nanopore Technologies.
For all third-party reagents, we recommend following the manufacturer's instructions to prepare the reagents for use.
Check your flow cell
We highly recommend that you check the number of pores in your flow cell prior to starting a sequencing experiment. This should be done within 12 weeks of purchasing your PromethION Flow Cells. Oxford Nanopore Technologies will replace any unused flow cell with fewer than the number of pores listed in the Table below, when the result is reported within two days of performing the flow cell check, and when the storage recommendations have been followed. To do the flow cell check, please follow the instructions in the Flow Cell Check document.
| Flow cell | Minimum number of active pores covered by warranty |
|---|---|
| PromethION Flow Cell | 5000 |
PCR Expansion (EXP-PCA001) contents
Note: For this protocol, only PCR Primers (PRM) are required.
Ligation Sequencing Kit V14 (SQK-LSK114) contents
Note: This product contains AMPure XP reagent manufactured by Beckman Coulter, Inc. and can be stored at -20°C with the kit without detriment to reagent stability.
Note: The DNA Control Sample (DCS) is a 3.6 kb standard amplicon mapping the 3' end of the Lambda genome.
3. Pre-pull-down PCR
材料
- 10 ng of cDNA amplicons prepared using the 10x Genomics Chromium GEM-X Universal 3’ Gene Expression (V4) assay or the Chromium Next GEM Universal 3’ Gene Expression (V3.1) assay
- Custom ordered-oligo at 10 μM: [Btn]Fwd_3580_partial_read1_defined_for_3'_cDNA (sequence provided in Equipment and Consumables)
- Custom-ordered oligo at 10 μM: Rev_PR2_partial_TSO_defined_for_3'_cDNA (sequence provided in Equipment and Consumables)
消耗品
- LongAmp Hot Start Taq 2X Master Mix (NEB, M0533)
- Agencourt AMPure XP beads (Beckman Coulter™ cat # A63881)
- nuclease-free waterで調整した 80% エタノール溶液
- Nuclease-free water (e.g. ThermoFisher, cat # AM9937)
- 1.5 ml Eppendorf DNA LoBind tubes
- 0.2 ml 薄壁のPCRチューブ
装置
- サーマルサイクラー
- 小型遠心機
- Hula mixer(緩やかに回転するミキサー)
- Magnetic rack (e.g. Invitrogen DynaMag-2 Magnet, Cat # 12321D)
- アイスバケツ(氷入り)
- P1000 ピペット及びチップ
- P200 ピペットとチップ
- P100 ピペットとチップ
- P20 ピペットとチップ
- P2 ピペットとチップ
Check your flow cell.
We recommend performing a flow cell check before starting your library prep to ensure you have a flow cell with enough pores for a good sequencing run.
See the flow cell check document for more information.
Prepare the cDNA amplicons in nuclease-free water:
- Transfer 10 ng of cDNA amplicons into a 0.2 ml thin-walled PCR tube.
- Adjust the volume to 21 µl with nuclease-free water.
- Mix thoroughly by flicking the tube to avoid unwanted shearing.
- Spin down briefly in a microfuge.
In the same 0.2 ml thin-walled PCR tube, set up the following biotin tagging reaction:
| Reagent | Stock | Final | Volume |
|---|---|---|---|
| cDNA template | 0.48 ng/μl | 0.2 ng/μl | 21 μl |
| [Btn]Fwd_3580_partial_read1_defined_for_3'_cDNA | 10 μM | 0.4 μM | 2 μl |
| Rev_PR2_partial_TSO_defined_for_3'_cDNA | 10 μM | 0.4 μM | 2 μl |
| LongAmp Hot Start Taq 2X Master Mix | 2X | 1X | 25 μl |
| Total | - | - | 50 μl |
Mix by pipetting and spin down.
Amplify using the following cycling conditions:
| Cycle step | Temperature | Ramp rate | Time | No. of cycles |
|---|---|---|---|---|
| Initial denaturation | 94°C | max | 3 min | 1 |
| Denaturation Annealing ramp-down Annealing Extension | 94°C 66°C down to 58°C 58°C 65°C | max 0.2°C/s max max | 30 sec 40 sec 50 sec 6 mins | 4 |
| Final extension | 65°C | max | 10 min | 1 |
| Hold | 4°C | - | ∞ | - |
Below is a schematic of the cycling conditions. 
Transfer the sample to a clean 1.5 ml Eppendorf DNA LoBind tube.
Resuspend the AMPure XP beads by vortexing.
Add 40 µl of resuspended AMPure XP beads to the reaction and mix by flicking the tube.
Incubate on a Hula mixer (rotator mixer) for 5 minutes at room temperature.
Prepare 500 μl of fresh 80% ethanol in nuclease-free water.
Spin down the samples and pellet the beads on a magnet until the eluate is clear and colourless. Keep the tubes on the magnet and pipette off the supernatant.
Keep the tube on the magnet and wash the beads with 200 µl of freshly prepared 80% ethanol in nuclease-free water without disturbing the pellet. Remove the ethanol using a pipette and discard.
Repeat the previous step.
Briefly spin down and place the tubes back on the magnet. Pipette off any residual ethanol. Allow to dry for 30 seconds, but do not dry the pellet to the point of cracking.
Remove the tube from the magnetic rack and resuspend the pellet in 10 µl nuclease-free water. Spin down and incubate for 2 minutes at room temperature.
Pellet the beads on a magnet until the eluate is clear and colourless.
Remove and retain 10 µl of eluate into a clean 1.5 ml Eppendorf DNA LoBind tube.
Take forward 10 µl of biotinylated cDNA into the pull-down step.
4. Pull-down
材料
- 10 μl of biotinylated cDNA
消耗品
- 1 M Tris-HCl, pH 7.5
- 5 M NaCl (Sigma, 71386)
- 0.5 M EDTA, pH 8 (Thermo Scientific, R1021)
- M280 streptavidin, 10 μg/μl (Invitrogen, 11205D)
- Nuclease-free water (e.g. ThermoFisher, AM9937)
- 15 ml Falcon tubes
- 1.5 ml Eppendorf DNA LoBind tubes
- 0.2 ml 薄壁のPCRチューブ
装置
- ボルテックスミキサー
- 小型遠心機
- Hula mixer(緩やかに回転するミキサー)
- Magnetic rack (e.g. Invitrogen DynaMag-2 Magnet, Cat # 12321D)
- アイスバケツ(氷入り)
- P1000 ピペット及びチップ
- P200 ピペットとチップ
- P100 ピペットとチップ
- P20 ピペットとチップ
- P2 ピペットとチップ
Prepare 200 μl of 10 mM Tris-HCl pH 7.5 for later use.
Prepare 4 ml of 2X wash/bind buffer (10 mM Tris-HCl pH 7.5, 2 M NaCl, 1 mM EDTA).
| Reagent | Stock concentration | Final concentration | Volume |
|---|---|---|---|
| Tris-HCl pH 7.5 | 1 M | 10 mM | 40 μl |
| NaCl | 5 M | 2 M | 1600 μl |
| EDTA | 0.5 M | 1 mM | 8 μl |
| Nuclease-free water | - | - | 2352 μl |
| Total | - | - | 4000 μl |
Transfer 3.5 ml of 2X wash/bind buffer (10 mM Tris-HCl pH 7.5, 2 M NaCl, 1 mM EDTA) to a clean 15 ml Falcon tube.
Add 3.5 ml of nuclease-free water to the same 15 ml Falcon tube to make 7 ml of 1X wash/bind buffer.
Resuspend the M280 streptavidin beads (10 μg/μl) by vortexing.
Transfer 5 μl of the streptavidin beads to a clean 1.5 ml Eppendorf DNA LoBind tube.
Add 1 ml of 1X wash/bind buffer and vortex the beads with buffer for 5 seconds.
Spin down the tube and pellet the beads on a magnet for two minutes, then pipette off the supernatant.
Repeat steps 7 and 8 two more times for a total of three washes.
It is critical that 2X buffer is used for the next step. Using 1X buffer will result in inefficient binding.
Resuspend the beads in 10 μl of 2X wash/bind buffer to achieve a final bead concentration of 5 μg/μl.
Add 10 μl of 5 μg/μl prepared beads (50 μg beads total) to the tube with 10 μl of biotinylated cDNA.
Incubate on a Hula mixer (rotator mixer) for 20 minutes at room temperature.
In the next steps, it is critical to pellet the beads on the magnet for the specified timings to ensure none are left in solution as the beads are difficult to see.
Add 1 ml of 1X wash/bind buffer and vortex the DNA and beads with buffer for 5 seconds.
Spin down the tube and pellet the beads on a magnet for three minutes, then pipette off the supernatant. Take care to not aspirate any of the beads.
Repeat the steps 13 and 14 two more times for a total of three washes.
Add 200 μl of 10 mM Tris-HCl pH 7.5 and vortex the beads for 5 seconds.
Spin down and place the tube back on the magnet for three minutes. Pipette off the supernatant.
Remove the tube from the magnetic rack and resuspend the pellet in 20 μl of nuclease-free water.
Vortex for 5 seconds and briefly spin down to collect the amplicon-bead conjugate.
Take forwards 20 μl of the amplicon-bead conjugate into the post-pull-down PCR step.
5. Post-pull-down PCR
材料
- 20 μl of the amplicon-bead conjugate
- PCR Primers (PRM)
消耗品
- LongAmp Hot Start Taq 2X Master Mix (NEB, M0533)
- Agencourt AMPure XP beads (Beckman Coulter™ cat # A63881)
- Qubit 1x dsDNA HS Assay Kit (ThermoFisher, Q33230)
- Agilent Technologies DNA 12000 Kit
- nuclease-free waterで調整した 80% エタノール溶液
- Nuclease-free water (e.g. ThermoFisher, cat # AM9937)
- 0.2 ml 薄壁のPCRチューブ
- 1.5 ml Eppendorf DNA LoBind tubes
- Qubit™ Assay Tubes (Invitrogen, Q32856)
装置
- サーマルサイクラー
- ボルテックスミキサー
- Hula mixer (rotator mixer)
- Magnetic rack (e.g. Invitrogen DynaMag-2 Magnet, Cat # 12321D)
- 小型遠心機
- アイスバケツ(氷入り)
- P1000 ピペット及びチップ
- P200 ピペットとチップ
- P100 ピペットとチップ
- P20 ピペットとチップ
- P10 ピペットとチップ
- P2 ピペットとチップ
- Qubit蛍光光度計(またはQCチェックのための同等品)
オプション装置
- Agilent Bioanalyzer (or equivalent)
Thaw the PCR Primers (PRM) at room temperature, then spin down and place on ice.
In a 0.2 ml thin-walled PCR tube, prepare the following PCR reaction:
| Reagent | Stock | Final | Volume |
|---|---|---|---|
| PCR Primer (PRM) | 10 μM | 0.2 μM | 1 μl |
| Nuclease-free water | - | - | 4 μl |
| LongAmp Hot Start Taq 2X Master Mix | 2X | 1X | 25 μl |
| Total | - | - | 30 μl |
Mix by pipetting.
Resuspend the amplicon-bead conjugate by pipetting and then transfer 20 μl of the conjugate into the 0.2 ml thin-walled PCR tube containing the PCR reaction. Mix by pipetting.
Do not allow the amplicon-bead conjugate to precipitate or pellet before transferring to the thermal cycler.
Avoid leaving the amplicon-bead conjugate standing for long before transferring to the thermal cycler.
Ensure you DO NOT spin down or centrifuge the amplicon-bead conjugate.
Do not spin down the tube; transfer immediately to the thermal cycler and amplify using the following cycling conditions:
| Cycle step | Temperature | Time | No. of cycles |
|---|---|---|---|
| Initial denaturation | 94°C | 3 min | 1 |
| Denaturation Annealing Extension | 94°C 56°C 65°C | 15 sec 15 sec 6 min | 4 |
| Final extension | 65°C | 10 min | 1 |
| Hold | 4°C | ∞ | - |
Resuspend the AMPure XP beads by vortexing.
Transfer the sample to a clean 1.5 ml Eppendorf DNA LoBind tube.
Add 40 µl of resuspended AMPure XP beads to the reaction and mix by flicking the tube.
Incubate on a Hula mixer (rotator mixer) for 5 minutes at room temperature.
Prepare 500 μl of fresh 80% ethanol in nuclease-free water.
Spin down the sample and pellet on a magnet until the supernatant is clear and colourless. Keep the tube on the magnet, and pipette off the supernatant.
Keep the tube on the magnet and wash the beads with 200 µl of freshly prepared 80% ethanol in nuclease-free water without disturbing the pellet. Remove the ethanol using a pipette and discard.
Repeat the previous step.
Briefly spin down and place the tubes back on the magnet for the beads to pellet. Pipette off any residual ethanol. Allow to dry for 30 seconds, but do not dry the pellets to the point of cracking.
Remove the tube from the magnetic rack and resuspend the pellet in 15 µl nuclease-free water.
Pellet the beads on the magnet until the eluate is clear and colourless.
Remove and retain 15 µl of eluate into a clean 1.5 ml Eppendorf DNA LoBind tube.
Dispose of the pelleted beads
Quantify 1 µl of eluted sample using a Qubit fluorometer - recovery aim >100 ng total.
Quantify 200 fmol of cDNA from the average fragment size identified using an Agilent Bioanalyzer.
Alternatively, assume an average fragment size of 1 kbp.
Figure: Example amplicon fragment length distribution: three biological replicates of 3' cDNA from PBMCs prepared using the 10x Genomics Chromium Next GEM Universal 3’ Gene Expression (V3.1) assay, processed using the Oxford Nanopore Technologies 3' 10x cDNA protocol. Here the amplicons have been analysed using the Agilent Bioanalyzer 2100 and DNA 12000 kit.
Take forward 200 fmol of cDNA into the end-prep step.
6. End-prep
材料
- 200 fmol cDNA amplicons
- AMPure XP Beads (AXP)
消耗品
- NEBNext® Ultra II End Prep Enzyme Mix from NEBNext® Ultra II End Repair Module (NEB, E7546)
- NEBNext® Ultra II End Prep Reaction Buffer from NEBNext® Ultra II End Repair Module (NEB, E7546)
- Qubit dsDNA HS Assay Kit (Invitrogen, Q32851)
- Nuclease-free water (e.g. ThermoFisher, AM9937)
- nuclease-free waterで調整した 80% エタノール溶液
- 0.2 ml 薄壁のPCRチューブ
- 1.5 ml Eppendorf DNA LoBind tubes
- Qubit™ Assay Tubes (Invitrogen, Q32856)
装置
- P1000 ピペット及びチップ
- P100 ピペットとチップ
- P10 ピペットとチップ
- サーマルサイクラー
- 小型遠心機
- Hula mixer(緩やかに回転するミキサー)
- マグネットラック
- アイスバケツ(氷入り)
- Qubit蛍光光度計(またはQCチェックのための同等品)
Prepare the NEBNext Ultra II End Repair / dA-tailing Module reagents in accordance with manufacturer's instructions, and place on ice:
For optimal performance, NEB recommend the following:
Thaw all reagents on ice.
Ensure the reagents are well mixed.
Note: Do not vortex the Ultra II End Prep Enzyme Mix.Always spin down tubes before opening for the first time each day.
The NEBNext Ultra II End Prep Reaction Buffer may contain a white precipitate. If this occurs, allow the mixture to come to room temperature and pipette the buffer several times to break up the precipitate, followed by a quick vortex to mix.
Transfer 200 fmol of cDNA amplicons into a clean 0.2 ml thin-walled PCR tube and adjust the volume to 50 µl with nuclease-free water.
In the same 0.2 ml thin-walled PCR tube, mix the following:
Between each addition, pipette mix 10-20 times.
| Reagent | Volume |
|---|---|
| cDNA amplicons | 50 µl |
| Ultra II End-prep Reaction Buffer | 7 µl |
| Ultra II End-prep Enzyme Mix | 3 µl |
| Total | 60 µl |
Thoroughly mix the reaction by gently pipetting and briefly spinning down.
Using a thermal cycler, incubate at 20°C for 5 minutes and 65°C for 5 minutes, then hold at 4°C.
Transfer the DNA sample to a clean 1.5 ml Eppendorf DNA LoBind tube.
Resuspend the AMPure XP Beads (AXP) by vortexing.
Add 60 µl of resuspended the AMPure XP Beads (AXP) to the end-prep reaction and mix by flicking the tube.
Incubate on a Hula mixer (rotator mixer) for 5 minutes at room temperature.
Prepare 500 μl of fresh 80% ethanol in nuclease-free water.
Spin down the sample and pellet on a magnet until supernatant is clear and colourless. Keep the tube on the magnet, and pipette off the supernatant.
Keep the tube on the magnet and wash the beads with 200 µl of freshly prepared 80% ethanol without disturbing the pellet. Remove the ethanol using a pipette and discard.
Repeat the previous step.
Spin down and place the tube back on the magnet. Pipette off any residual ethanol. Allow to dry for ~30 seconds, but do not dry the pellet to the point of cracking.
Remove the tube from the magnetic rack and resuspend the pellet in 61 µl nuclease-free water by gently pipetting up and down or by flicking the tube. Incubate for 2 minutes at room temperature.
Pellet the beads on a magnet until the eluate is clear and colourless, for at least 1 minute.
Remove and retain 61 µl of eluate into a clean 1.5 ml Eppendorf DNA LoBind tube.
Quantify 1 µl of eluted sample using a Qubit fluorometer.
Take forward the repaired and end-prepped DNA into the adapter ligation step. However, at this point it is also possible to store the sample at 4°C overnight.
7. Adapter ligation and clean-up
材料
- Ligation Adapter (LA)
- Ligation Buffer (LNB)
- Short Fragment Buffer (SFB)
- AMPure XP Beads (AXP)
- Elution Buffer (EB)
消耗品
- Qubit dsDNA HS Assay Kit (Invitrogen, Q32851)
- Salt-T4® DNA Ligase (NEB, M0467)
- 1.5 ml Eppendorf DNA LoBind tubes
- Qubit™ Assay Tubes (Invitrogen, Q32856)
装置
- マグネットラック
- Hula mixer (rotator mixer)
- 小型遠心機
- ボルテックスミキサー
- P1000 ピペット及びチップ
- P100 ピペットとチップ
- P20 ピペットとチップ
- P10 ピペットとチップ
- Qubit蛍光光度計(またはQCチェックのための同等品)
We recommend using the Salt-T4® DNA Ligase (NEB, M0467).
Salt-T4® DNA Ligase (NEB, M0467) can be bought separately or is provided in the NEBNext® Companion Module v2 for Oxford Nanopore Technologies® Ligation Sequencing (catalogue number E7672S or E7672L).
The Quick T4 DNA Ligase (NEB, E6057) available in the previous version NEBNext® Companion Module for Oxford Nanopore Technologies® Ligation Sequencing (NEB, E7180S or E7180L) is also compatible, but the new recommended reagent offers more efficient and ligation.
Although third-party ligase products may be supplied with their own buffer, the ligation efficiency of the Ligation Adapter (LA) is higher when using the Ligation Buffer (LNB) supplied in the Ligation Sequencing Kit.
Spin down the Ligation Adapter (LA) and Salt-T4® DNA Ligase, and place on ice.
Thaw Ligation Buffer (LNB) at room temperature, spin down and mix by pipetting. Due to viscosity, vortexing this buffer is ineffective. Place on ice immediately after thawing and mixing.
Thaw the Elution Buffer (EB) at room temperature and mix by vortexing. Then spin down and place on ice.
Thaw the Short Fragment Buffer (SFB) at room temperature and mix by vortexing. Then spin down and place on ice.
In a 1.5 ml Eppendorf DNA LoBind tube, mix in the following order:
| Reagent | Volume |
|---|---|
| DNA sample from the previous step | 60 µl |
| Ligation Adapter (LA) | 5 µl |
| Ligation Buffer (LNB) | 25 µl |
| Salt-T4® DNA Ligase | 10 µl |
| Total | 100 µl |
Mix by flicking until homogenous.
Thoroughly mix the reaction by gently pipetting and briefly spinning down.
Incubate the reaction for 10 minutes at room temperature.
Resuspend the AMPure XP Beads (AXP) by vortexing.
Add 40 µl of resuspended AMPure XP Beads (AXP) to the reaction and mix by flicking the tube.
Incubate on a Hula mixer (rotator mixer) for 5 minutes at room temperature.
Spin down the sample and pellet on a magnet. Keep the tube on the magnet, and pipette off the supernatant when clear and colourless.
Wash the beads by adding 250 μl of Short Fragment Buffer (SFB). Flick the beads to resuspend, spin down, then return the tube to the magnetic rack and allow the beads to pellet. Remove the supernatant using a pipette and discard.
Note: Take care when removing the supernatant, the viscosity of the buffer can contribute to loss of beads from the pellet.
Repeat the previous step.
Spin down and place the tube back on the magnet. Pipette off any residual supernatant. Allow to dry for ~30 seconds, but do not dry the pellet to the point of cracking.
Remove the tube from the magnetic rack and resuspend the pellet in 34 µl Elution Buffer (EB).
Spin the sample down briefly and incubate for 10 minutes at room temperature.
Pellet the beads on a magnet until the eluate is clear and colourless, for at least 1 minute.
Remove and retain 34 µl of eluate containing the DNA library into a clean 1.5 ml Eppendorf DNA LoBind tube.
Quantify 1 µl of eluted sample using a Qubit fluorometer.
Prepare 50–100 fmol of your final library to 32 µl with Elution Buffer (EB).
Alternatively, assume an average fragment length of 1 kbp and proceed with 33 ng of library.
Note: If your DNA library is below the required concentration, take forward the full volume of 32 µl eluted DNA for sequencing.
Caution: Please note, very low recovery could be indicative of library preparation failiure.
If required, we recommend using a mass to mol calculator such as the NEB calculator.
We recommend loading 50–100 fmol of this final prepared library onto the R10.4.1 flow cell.
Loading the recommended concentration onto the flow cell will ensure optimal pore occupancy for high sequencing output. Dilute the library in Elution Buffer if required.
The prepared library is used for loading into the flow cell. Store the library on ice or at 4°C until ready to load.
Library storage recommendations
We recommend storing libraries in Eppendorf DNA LoBind tubes at 4°C for short-term storage or repeated use, for example, re-loading flow cells between washes. For single use and long-term storage of more than 3 months, we recommend storing libraries at -80°C in Eppendorf DNA LoBind tubes.
8. Priming and loading the PromethION Flow Cell
材料
- Sequencing Buffer (SB)
- Library Beads (LIB)
- Library Solution (LIS)
- Flow Cell Tether (FCT)
- Flow Cell Flush (FCF)
消耗品
- PromethION Flow Cell
- 1.5 ml Eppendorf DNA LoBind tubes
装置
- PromethION device
- PromethION Flow Cell Light Shield
- P1000 ピペット及びチップ
- P200 ピペットとチップ
- P20 ピペットとチップ
This kit is only compatible with R10.4.1 flow cells (FLO-PRO114M).
After taking the flow cell out of the fridge, wait 20 minutes for the flow cell to reach room temperature, before inserting it into the PromethION. Condensation can form on the flow cell in humid environments. Inspect the gold connector pins on the top and underside of the flow cell for condensation and wipe off with a lint-free wipe if any is observed. Ensure the heat pad (black pad) is present on the underside of the flow cell.
Thaw the Sequencing Buffer (SB), Library Beads (LIB) or Library Solution (LIS, if using), Flow Cell Tether (FCT) and Flow Cell Flush (FCF) at room temperature before mixing by vortexing. Then spin down and store on ice.
To prepare the flow cell priming mix, combine Flow Cell Tether (FCT) and Flow Cell Flush (FCF), as directed below. Mix by vortexing at room temperature.
In a clean suitable tube for the number of flow cells, combine the following reagents:
| Reagent | Volume per flow cell |
|---|---|
| Flow Cell Flush (FCF) | 1,170 µl |
| Flow Cell Tether (FCT) | 30 µl |
| Total volume | 1,200 µl |
Load the flow cell(s) into the docking ports of the PromethION 24/48 as follows:
- Line up the flow cell with the connector horizontally and vertically before smoothly inserting into position.
- Press down firmly onto the flow cell and ensure the latch engages and clicks into place.


Insertion of the flow cells at the wrong angle can cause damage to the pins on the PromethION and affect your sequencing results. If you find the pins on a PromethION position are damaged, please contact support@nanoporetech.com for assistance.

Complete a flow cell check to assess the number of pores available before loading the library.
This step can be omitted if the flow cell has been checked previously.
See the flow cell check document for more information.
Slide the inlet port cover clockwise to open.

Take care when drawing back buffer from the flow cell. Do not remove more than 20-30 µl, and make sure that the array of pores are covered by buffer at all times. Introducing air bubbles into the array can irreversibly damage pores.
After opening the inlet port, draw back a small volume to remove any air bubbles:
- Set a P1000 pipette tip to 200 µl.
- Insert the tip into the inlet port.
- Turn the wheel until the dial shows 220-230 µl, or until you see a small volume of buffer entering the pipette tip.

Load 500 µl of the priming mix into the flow cell via the inlet port, avoiding the introduction of air bubbles. Wait five minutes. During this time, prepare the library for loading using the next steps in the protocol.

Thoroughly mix the contents of the Library Beads (LIB) by pipetting.
The Library Beads (LIB) tube contains a suspension of beads. These beads settle very quickly. It is vital that they are mixed immediately before use.
We recommend using the Library Beads (LIB) for most sequencing experiments. However, the Library Solution (LIS) is available for more viscous libraries.
In a new 1.5 ml Eppendorf DNA LoBind tube, prepare the library for loading as follows:
| Reagent | Volume per flow cell |
|---|---|
| Sequencing Buffer (SB) | 100 µl |
| Library Beads (LIB) thoroughly mixed before use, or Library Solution (LIS) | 68 µl |
| DNA library | 32 µl |
| Total | 200 µl |
Note: Library loading volume has been increased to improve array coverage.
Complete the flow cell priming by slowly loading 500 µl of the priming mix into the inlet port.

Mix the prepared library gently by pipetting up and down just prior to loading.
Load 200 µl of library into the inlet port using a P1000 pipette.

Close the valve to seal the inlet port.
For optimal sequencing output, install the light shield on your flow cell as soon as the library has been loaded.
We recommend leaving the light shield on the flow cell when library is loaded, including during any washing and reloading steps. The shield can be removed when the library has been removed from the flow cell.
If the light shield has been removed from the flow cell, install the light shield as follows:
- Align the inlet port cut out of the light shield with the inlet port cover on the flow cell. The leading edge of the light shield should sit above the flow cell ID.
- Firmly press the light shield around the inlet port cover. The inlet port clip will click into place underneath the inlet port cover.


Close the PromethION lid when ready to start a sequencing run on MinKNOW.
Wait a minimum of 10 minutes after loading the flow cells onto the PromethION before initiating any experiments. This will help to increase the sequencing output.
9. Data acquisition and basecalling
We do not recommend sequencing and performing data analysis simultaneously on your device.
To ensure the compute on your device can keep up with the requirements for sequencing and/or analysis, we strongly recommend against running both processes at the same time.
Ensure your sequencing run has completed before setting off data analysis. Data analysis will be performed post-sequencing.
Equally, we do not recommend starting a sequencing run if you are currently performing data analysis on your device.
Ensure you are using the most recent version of MinKNOW.
We strongly recommend updating MinKNOW to the latest version on your device prior to starting a sequencing run.
For more information on updating MinKNOW, please refer to our MinKNOW protocol.
How to start sequencing
The sequencing device control and data acquisition are carried out by the MinKNOW software. Please ensure MinKNOW is installed on your computer or device. Further instructions for setting up a sequencing run can be found in the MinKNOW protocol.
We recommend setting up your sequencing run using the recommendations outlined below. All other parameters can be left to their default settings.
MinKNOW settings
Below are the recommendations for MinKNOW settings:
Positions
Flow cell position: [user defined]
Experiment name: [user defined]
Flow cell type: FLO-PRO114M
Sample ID: [user defined]
Kit
Kit selection: Ligation Sequencing Kit (SQK-LSK114)
Run configuration
Sequencing and analysis
Basecalling: On
Modified bases: Off [default]
Model: High-accuracy basecaller (HAC)
Barcoding: Off [default]
Alignment: Off [default]
Adaptive sampling: Off [default]
Advanced options
Time between pore scans: 1.5 [default]
Reserve pores: On [default]
Data targets
Run limit: Stop run when sequencing reaches 72 hours
Output
Output format
.BAM: Off
.FASTQ: Off
Raw reads: On [default]
.POD5: On [default]
Filtering: On [default]
Qscore: 8 [default]
Minimum read length: 200 b
Data analysis after sequencing
After sequencing has completed on MinKNOW, the flow cell can be reused or returned, as outlined in the Flow cell reuse and returns section.
After sequencing and basecalling, the data can be analysed, as outlined in the Downstream analysis section.
10. Flow cell reuse and returns
材料
- Flow Cell Wash Kit (EXP-WSH004)
After your sequencing experiment is complete, if you would like to reuse the flow cell, please follow the Flow Cell Wash Kit protocol and store the washed flow cell at +2°C to +8°C.
The Flow Cell Wash Kit protocol is available on the Nanopore Community.
Alternatively, follow the returns procedure to send the flow cell back to Oxford Nanopore.
Instructions for returning flow cells can be found here.
If you encounter issues or have questions about your sequencing experiment, please refer to the Troubleshooting Guide that can be found in the online version of this protocol.
11. Downstream analysis
Downstream analysis for single-cell transcriptomics sequencing from 3’ cDNA
The sequencing output files (.fastq or .bam) can be analysed using wf-single-cell, a bioinformatics workflow implemented in Nextflow that is part of Oxford Nanopore Technologies EPI2ME suite of analysis workflows. wf-single-cell is intended to be run from the command line but can also be run within the EPI2ME desktop app. wf-single-cell is available on GitHub.
Running wf-single-cell
To run the workflow from the command line:
nextflow run epi2me-labs/wf-single-cell \
--expected_cells <CELL NUMBER> \
--fastq <READS> \
--kit <KIT> \
--ref_genome_dir <REFERENCE> \
-profile standard
Where expected_cells is the number of target cells from your 10x Chromium run, fastq (or bam) is the location of the basecalled reads, kit is the 10x kit and version used (e.g. 3prime:v4), and ref_genome_dir is the location of the reference genome and annotation files as per 10x reference format (for more information see the 10x downloads centre).
Nextflow and either Docker or Singularity must be installed on your system to run the workflow. See EPI2ME Quick Start guide for additional information on how to run EPI2ME workflows from the command line.
Latest information and further details on how to run the workflow and additional parameters can be found in the workflow's GitHub page and documentation.
Output files
wf-single-cell produces an interactive HTML report, which includes basic QC metrics (sequencing score, read lengths), experiment summary (number of cells, mean reads per cell, etc), and diagnostic knee and saturation plots, as well as UMAP plots for visualising cell clusters. It also outputs gene and transcript expression matrices in a format compatible with popular downstream analysis tools.
12. Issues during DNA extraction and library preparation
Below is a list of the most commonly encountered issues, with some suggested causes and solutions.
We also have an FAQ section available on the Nanopore Community Support section.
If you have tried our suggested solutions and the issue still persists, please contact Technical Support via email (support@nanoporetech.com) or via LiveChat in the Nanopore Community.
Low sample quality
| Observation | Possible cause | Comments and actions |
|---|---|---|
| Low DNA purity (Nanodrop reading for DNA OD 260/280 is <1.8 and OD 260/230 is <2.0–2.2) | The DNA extraction method does not provide the required purity | The effects of contaminants are shown in the Contaminants document. Please try an alternative extraction method that does not result in contaminant carryover. Consider performing an additional SPRI clean-up step. |
Low DNA recovery after AMPure bead clean-up
| Observation | Possible cause | Comments and actions |
|---|---|---|
| Low recovery | DNA loss due to a lower than intended AMPure beads-to-sample ratio | 1. AMPure beads settle quickly, so ensure they are well resuspended before adding them to the sample. 2. When the AMPure beads-to-sample ratio is lower than 0.4:1, DNA fragments of any size will be lost during the clean-up. |
| Low recovery | DNA fragments are shorter than expected | The lower the AMPure beads-to-sample ratio, the more stringent the selection against short fragments. Please always determine the input DNA length on an agarose gel (or other gel electrophoresis methods) and then calculate the appropriate amount of AMPure beads to use. 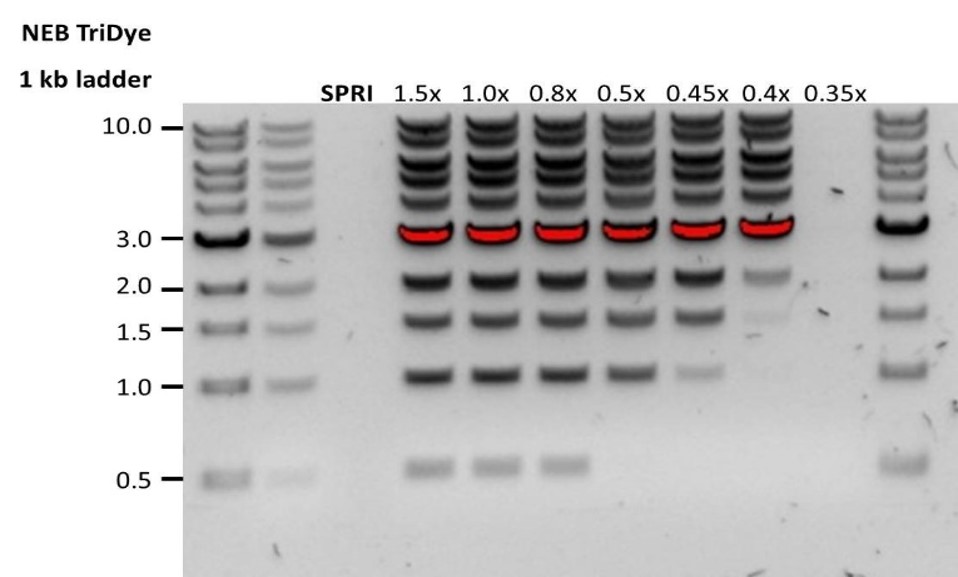 |
| Low recovery after end-prep | The wash step used ethanol <70% | DNA will be eluted from the beads when using ethanol <70%. Make sure to use the correct percentage. |
13. Issues during the sequencing run
Below is a list of the most commonly encountered issues, with some suggested causes and solutions.
We also have an FAQ section available on the Nanopore Community Support section.
If you have tried our suggested solutions and the issue still persists, please contact Technical Support via email (support@nanoporetech.com) or via LiveChat in the Nanopore Community.
Fewer pores at the start of sequencing than after Flow Cell Check
| Observation | Possible cause | Comments and actions |
|---|---|---|
| MinKNOW reported a lower number of pores at the start of sequencing than the number reported by the Flow Cell Check | An air bubble was introduced into the nanopore array | After the Flow Cell Check it is essential to remove any air bubbles near the priming port before priming the flow cell. If not removed, the air bubble can travel to the nanopore array and irreversibly damage the nanopores that have been exposed to air. The best practice to prevent this from happening is demonstrated in this video for how to load a PromethION Flow Cell. |
| MinKNOW reported a lower number of pores at the start of sequencing than the number reported by the Flow Cell Check | The flow cell is not correctly inserted into the device | Stop the sequencing run, remove the flow cell from the sequencing device and insert it again, checking that the flow cell is firmly seated in the device and that it has reached the target temperature. If applicable, try a different position on the device (GridION/PromethION). |
| MinKNOW reported a lower number of pores at the start of sequencing than the number reported by the Flow Cell Check | Contaminations in the library damaged or blocked the pores | The pore count during the Flow Cell Check is performed using the QC DNA molecules present in the flow cell storage buffer. At the start of sequencing, the library itself is used to estimate the number of active pores. Because of this, variability of about 10% in the number of pores is expected. A significantly lower pore count reported at the start of sequencing can be due to contaminants in the library that have damaged the membranes or blocked the pores. Alternative DNA/RNA extraction or purification methods may be needed to improve the purity of the input material. The effects of contaminants are shown in the Contaminants Know-how piece. Please try an alternative extraction method that does not result in contaminant carryover. |
MinKNOW script failed
| Observation | Possible cause | Comments and actions |
|---|---|---|
| MinKNOW shows "Script failed" | Restart the computer and then restart MinKNOW. If the issue persists, please collect the MinKNOW log files and contact Technical Support. If you do not have another sequencing device available, we recommend storing the flow cell and the loaded library at 4°C and contact Technical Support for further storage guidance. |
Pore occupancy below 40%
| Observation | Possible cause | Comments and actions |
|---|---|---|
| Pore occupancy <40% | Not enough library was loaded on the flow cell | Ensure you load the recommended amount of good quality library in the relevant library prep protocol onto your flow cell. Please quantify the library before loading and calculate mols using tools like the Promega Biomath Calculator, choosing "dsDNA: µg to pmol" |
| Pore occupancy close to 0 | The Ligation Sequencing Kit was used, and sequencing adapters did not ligate to the DNA | Make sure to use the NEBNext Quick Ligation Module (E6056) and Oxford Nanopore Technologies Ligation Buffer (LNB, provided in the sequencing kit) at the sequencing adapter ligation step, and use the correct amount of each reagent. A Lambda control library can be prepared to test the integrity of the third-party reagents. |
| Pore occupancy close to 0 | The Ligation Sequencing Kit was used, and ethanol was used instead of LFB or SFB at the wash step after sequencing adapter ligation | Ethanol can denature the motor protein on the sequencing adapters. Make sure the LFB or SFB buffer was used after ligation of sequencing adapters. |
| Pore occupancy close to 0 | No tether on the flow cell | Tethers are added during flow cell priming (FLT/FCT tube). Make sure FLT/FCT was added to FB/FCF before priming. |
Shorter than expected read length
| Observation | Possible cause | Comments and actions |
|---|---|---|
| Shorter than expected read length | Unwanted fragmentation of DNA sample | Read length reflects input DNA fragment length. Input DNA can be fragmented during extraction and library prep. 1. Please review the Extraction Methods in the Nanopore Community for best practice for extraction. 2. Visualise the input DNA fragment length distribution on an agarose gel before proceeding to the library prep. 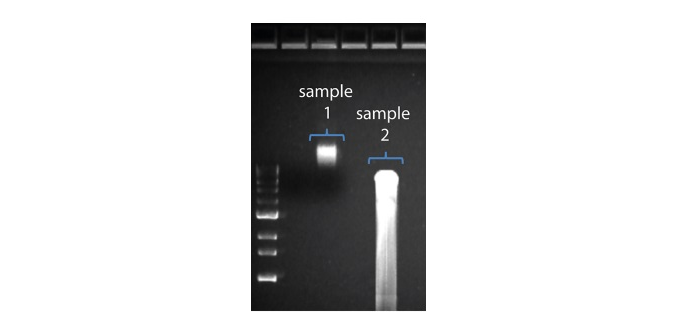 In the image above, Sample 1 is of high molecular weight, whereas Sample 2 has been fragmented. In the image above, Sample 1 is of high molecular weight, whereas Sample 2 has been fragmented.3. During library prep, avoid pipetting and vortexing when mixing reagents. Flicking or inverting the tube is sufficient. |
Large proportion of unavailable pores
| Observation | Possible cause | Comments and actions |
|---|---|---|
Large proportion of unavailable pores (shown as blue in the channels panel and pore activity plot) 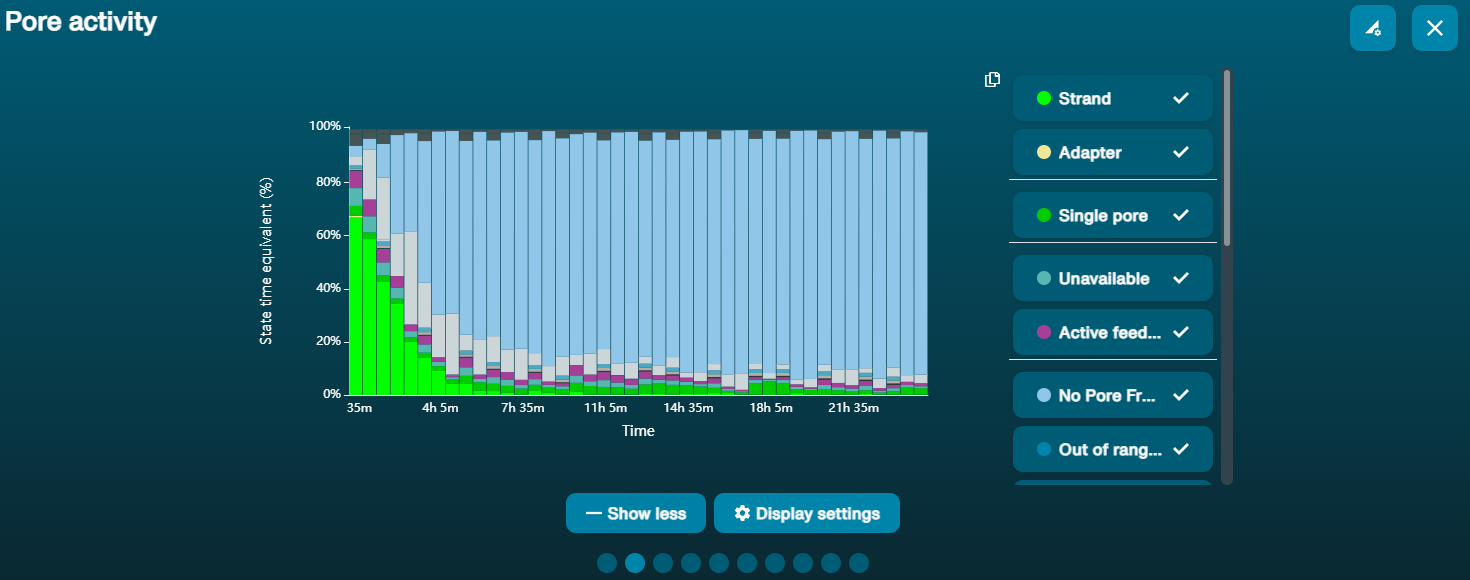 The pore activity plot above shows an increasing proportion of "unavailable" pores over time. The pore activity plot above shows an increasing proportion of "unavailable" pores over time. | Contaminants are present in the sample | Some contaminants can be cleared from the pores by the unblocking function built into MinKNOW. If this is successful, the pore status will change to "sequencing pore". If the portion of unavailable pores stays large or increases: 1. A nuclease flush using the Flow Cell Wash Kit (EXP-WSH004) can be performed, or 2. Run several cycles of PCR to try and dilute any contaminants that may be causing problems. |
Large proportion of inactive pores
| Observation | Possible cause | Comments and actions |
|---|---|---|
| Large proportion of inactive/unavailable pores (shown as light blue in the channels panel and pore activity plot. Pores or membranes are irreversibly damaged) | Air bubbles have been introduced into the flow cell | Air bubbles introduced through flow cell priming and library loading can irreversibly damage the pores. Watch the how to load a PromethION Flow Cell video for best practice. |
| Large proportion of inactive/unavailable pores | Contaminants are present in the sample | The effects of contaminants are shown in the Contaminants Know-how piece. Please try an alternative extraction method that does not result in contaminant carryover. |
Temperature fluctuation
| Observation | Possible cause | Comments and actions |
|---|---|---|
| Temperature fluctuation | The flow cell has lost contact with the device | Check that there is a heat pad covering the metal plate on the back of the flow cell. Re-insert the flow cell and press it down to make sure the connector pins are firmly in contact with the device. If the problem persists, please contact Technical Services. |
Failed to reach target temperature
| Observation | Possible cause | Comments and actions |
|---|---|---|
| MinKNOW shows "Failed to reach target temperature" | The instrument was placed in a location that is colder than normal room temperature, or a location with poor ventilation (which leads to the flow cells overheating) | MinKNOW has a default timeframe for the flow cell to reach the target temperature. Once the timeframe is exceeded, an error message will appear and the sequencing experiment will continue. However, sequencing at an incorrect temperature may lead to a decrease in throughput and lower q-scores. Please adjust the location of the sequencing device to ensure that it is placed at room temperature with good ventilation, then re-start the process in MinKNOW. |







